CESUR ANATOMÍA – TÉCNICA HISTOLÓGICA
CESUR ANATOMÍA – TÉCNICAS HISTOLÓGICAS, para despedir el curso, la alumna de 2º del ciclo superior de formación profesional de Anatomía Patológica y Citodiagnóstico, Khadija El Iysaouy, ha escrito un post sobre las técnicas histológicas que los alumnos han aprendido ha desarrollar en el laboratorio.
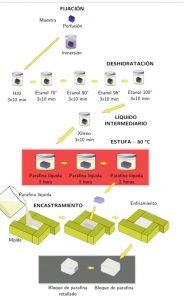
TÉCNICAS HISTOLÓGICAS
PASOS:
- OBTENCIÓN DE LA MUESTRA
- FIJACIÓN
- DESHIDRATACIÓN
- INCLUSIÓN Y FORMACIÓN DEL BLOQUE
- CORTE
- DESPARAFINACIÓN Y DESHIDRATACIÓN
- TINCIÓN Y MONTAJE
- OBSERVACIÓN AL MICROSCOPIO
1. OBTENCIÓN DE LA MUESTRA
Se realizan pequeños cortes de la muestra que queremos analizar y lo introducimos en unos cassetes de inclusión, indicando:
- tipo de muestra
- fecha
2. FIJACIÓN
El tejido en el cassete de inclusión y bien identificado se introduce en un líquido fijador(FORMOL) para:
- Conservar los tejidos de forma que muestren el mayor parecido posible a su estado in vivo.
- Aumentar la dureza del tejido para facilitar la preparación de finas películas de éste.
- Destruir bacterias y gérmenes que pudieran encontrarse en ellos.
- Interrumpir los procesos celulares dinámicos que ocurren a la muerte de la célula.
3. DESHIDRATACIÓN
Después de que la muestra haya sido fijada se procede a su deshidratación:
- Se pasa el tejido por diferentes graduaciones de etanol (70º,80º,96º,100º..) debido a que una gran parte del tejido está constituida por agua.
- Esto se hace por que si se colocara el tejido en una solución al 100% de alcohol inmediatamente, el agua saldría muy rápido del tejido y se deformaria.
4. INCLUSIÓN Y FORMACIÓN DEL BLOQUE
A fin de que se puedan obtener cortes suficientemente finos para ser observados al microscopio, los tejidos tienen que ser incluidos y envueltos por una sustancia de consistencia firme.
Las sustancias usadas para este fin son: gelatina y parafina.
El objetivo de la inclusión es:
- Distinguir entre sí las células superpuestas en un tejido y la matriz extracelular.
- Tener un objeto lo suficientemente duro para su manejo y corte.
5. CORTE
Los bloques de parafina, se extraen de los moldes metálicos para hacer los cortes: que se van a introducir en la bañera para después ser “pescados” con un portaobjetos.
- El bloque se puede cortar en secciones lo suficientemente delgadas como para permitir el paso de la luz.
- La mayor parte de los preparados para microscopía óptica tienen un grosor entre 3 a 10 micras.
- Para estos cortes se utiliza un aparato llamado microtomo.
Los cortes obtenidos se van a introducir en la bañera de flotación, donde se estirarán por el calor, para después ser “pescados” con un portaobjetos.
6. DESPARAFINACIÓN Y DESHIDRATACIÓN
Los cortes de tejido “pescados” en el portaobjetos se dejan en la estufa para que se disuelva la parafina (60ºc durante 2 horas).
Desparafinado y rehidratación: antes de teñir, ya que los colorantes son hidrofílicos, hay que pasarlos por xileno (desparafinado) y luego por concentraciones decrecientes de alcohol (rehidratación) para poder visualizarlos al microscopio.
7. TINCIÓN Y MONTAJE
Los colorantes más utilizados son: HEMATOXILINA-EOSINA
Montaje:La muestra teñida se cubre con un cristal (cubreobjetos) el cual se pega con depex (adhesivo comercial), evitando que se formen burbujas de aire, lo que daría lugar a artefactos al observar en el microscopio.
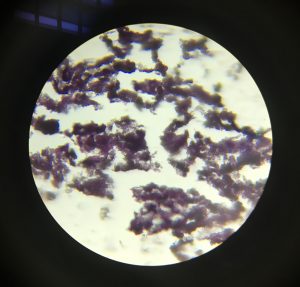
8. OBSERVACIÓN AL MICROSCOPIO
Una vez realizados todos los pasos anteriores ya se puede observar la muestra al microscopio y como resultados podremos observar:
- La hematoxilina al ser básica tiñe ácidos, de color morado (núcleos con DNA y RNA)
- La eosina es un ácido y tiñe bases, de color rosado (citoplasma)
Gracias Khadija por este post tan completo, un gran trabajo!!
María José Jiménez